EBUS-TBNA en la estadificación del cáncer de pulmón no microcítico
Alberto López Aráoz
Ex presidente STNBA
El cáncer de pulmón es la principal causa de mortalidad por cáncer, tanto en el hombre como en la mujer a nivel global. En argentina es la primera en hombres (18,6%) y la tercera en mujeres (10,7%)1 .
Después del diagnóstico histológico del cáncer de pulmón, su estadificación se vuelve la tarea más importante con la finalidad de establecer un pronóstico y una conducta terapéutica. Una vez descartadas las metástasis a distancia, una detallada estadificación locorregional es mandatorio, ya que el 30-44% de los casos diagnosticados tienen afectación mediastínica2 . La exclusión con la mayor certeza y la menor morbilidad posible la afectación de los ganglios mediastínicos se basa en técnicas de imagen, técnicas endoscópicas y procedimientos quirúrgicos.
Estadificación no invasiva
Las técnicas de imágenes incluyen la tomografía computada, la tomografía por emisión de positrones o ambas combinadas (PET-TC). El valor de la resonancia magnética en las imágenes del mediastino es mucho menor, sin embargo, un metaanálisis reciente sugirió que la precisión de la Resonancia Magnética ponderada por difusión para la estadificación del cáncer de pulmón en el mediastino y los ganglios hiliares puede ser comparable a la PET-CT3 .
La exactitud es vital para no sub o sobreestadificar. Se considera que el aumento del tamaño de los ganglios linfáticos en la tomografía computada es un predictor de riesgo de afectación maligna. La mayoría de los estudios que evalúan la utilidad de la tomografía computada para la estadificación del mediastino han utilizado un corte de 1 cm en el eje corto para definir un ganglio linfático anormal. El eje corto se identifica ubicando el diámetro más grande del ganglio linfático y luego midiendo el diámetro perpendicular más largo a esa línea. Con este valor de corte, las características operativas de la prueba dan como resultado una sensibilidad y una especificidad medianas agregadas del 55 % y el 81 %, respectivamente.; la combinación PET-TC lleva la sensibilidad al 80% y la especificidad al 90%.
Estadificación invasiva
La Sociedad Europea de Cirujanos Torácicos (ESTS) con la Sociedad Americana del Tórax (ATS) recomiendan4 el uso de procedimientos invasivos para obtener confirmación citológica y/o histológica para pacientes incluidos en las tres siguientes categorías definidas en la exploración PET-CT:
1. tumor mayor de 3 cm.
2. tumor de ubicación central incluso sin ganglios agrandados.
3. sospecha de enfermedad N1.
y recomiendan:
1. Para los pacientes con extensa infiltración mediastínica (sin metástasis a distancia), la TC es suficiente sin la confirmación invasiva. (Grado de recomendación, 2C )
2. Para los pacientes con discreto agrandamiento de los ganglios linfáticos del mediastino (sin metástasis a distancia), la confirmación invasiva se recomienda (sin importar si un hallazgo PET es positivo o negativo en los ganglios del mediastino).
3. Para los pacientes con un mediastino radiográficamente normal (por TAC) y un tumor central o N1, (sin metástasis a distancia), o Adenocarcinoma la confirmación invasiva se recomienda (sin importar si un hallazgo PET es positivo o negativo en los ganglios del mediastino) . (Grado de recomendación 1C)
4. Para los pacientes con discreto agrandamiento de los ganglios linfáticos del mediastino (sin metástasis a distancia), un resultado “no maligno” de una técnica por aguja debe ser confirmado por mediastinoscopía (independientemente de si un hallazgo PET es positivo o negativo en los ganglios del mediastino.
Para la obtención de las muestras histológicas/citológicas, la Sociedad Torácica Americana (ATS), la Sociedad Respiratoria Europea (ERS), la Sociedad Europea de Oncología Médica (ESMO) y el Colegio Estadounidense de Médicos del Tórax (ACCP), han publicado recomendaciones específicas para la estadificación mediastinal del cáncer de pulmón no microcítico5 y establecen que las técnicas utilizadas deben ser lo menos invasivas posible. Por lo tanto, el examen del mediastino debe comenzar con técnicas endoscópicas, siendo los métodos por punción, la primera línea para la estadificación mediastinal invasiva. Las técnicas quirúrgicas se utilizan para validar los resultados negativos obtenidos por las técnicas endoscópicas. Todo en el marco de un comité multidisciplinario de expertos en cáncer de pulmón para predecir el riesgo de malignidad en términos de compromiso ganglionar.
Las primeras descripciones de obtención de muestras de adenopatías mediastínicas a través de un broncoscopio rígido son del Dr. Eduardo Schieppati, un médico Argentino6 . En el año 1978, el Dr. Ko Pen Wang7 , tomando la idea del Dr. Schieppati, desarrolla una aguja para ser utilizada a través del canal de trabajo del broncofibroscopio (TBNA), llevando de esta manera a la ampliación de la indicación del abordaje broncoscopico del mediastino, el cual tuvo una aceptación limitada por lo heterogéneo de sus resultados, altamente “operador dependiente”, que variaban entre los diferentes autores de manera muy significativa8 . TBNA generalmente tiene una baja sensibilidad y una alta tasa de falsos negativos (78% y 28%, respectivamente). El uso de un dispositivo ecográfico para uso broncoscópico se introdujo en 1992 (EBUS radial) que mejoro el rendimiento de la TBNA. Luego de algunos prototipos, Olympus en 2003 presento el ecobroncoscopio lineal (EBUS lineal XBF-UC40P)9 . Las técnicas endoscópicas disponibles en la actualidad con mayor precisión diagnóstica son las técnicas de punción guiadas por ecografía endobronquial (EBUS).
EBUS
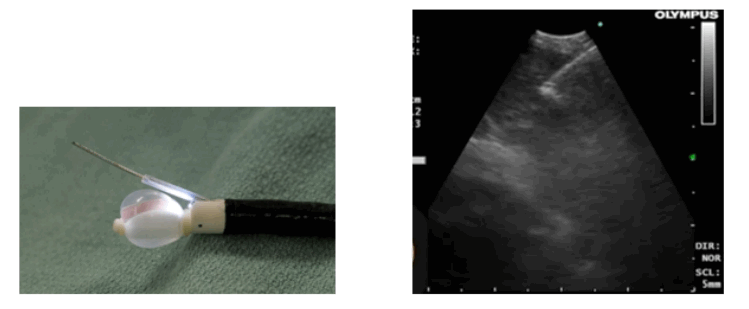
El EBUS consiste en un videobroncoscopio flexible con un diámetro exterior del tubo de inserción es de 6,7 mm, longitud de trabajo 550 mm (longitud total 870 mm). El rango de angulación del extremo distal del endoscopio es de 160° hacia arriba y 90° hacia abajo. El instrumento tiene un pequeño transductor electrónico curvo de matriz lineal, de 10 mm de longitud, ubicado en el extremo distal del endoscopio frente a una lente de fibra óptica de visión frontal oblicua de 30° (ángulo de visión de 80°). El diámetro del extremo distal del endoscopio con el transductor es de 6,9 mm y el endoscopio tiene un canal de biopsia de 2 mm. La frecuencia ultrasónica es de 7,5 MHz con una profundidad de penetración de 5 cm. El endoscopio se conecta a un procesador de ultrasonidos Olympus (US) (EU-C 60). cuyas señales son visualizadas junto con las imágenes broncoscópicas.
A través del canal de trabajo del equipo se introduce una aguja especialmente diseñada, eco refringente, que permite observar ecográficamente en tiempo real su introducción dentro del ganglio o lesión a estudiar.
El procedimiento puede hacerse de manera ambulatoria, habitualmente bajo sedación, casi siempre usamos una mascara laríngea, es decir no requiere intubación orotraqueal.
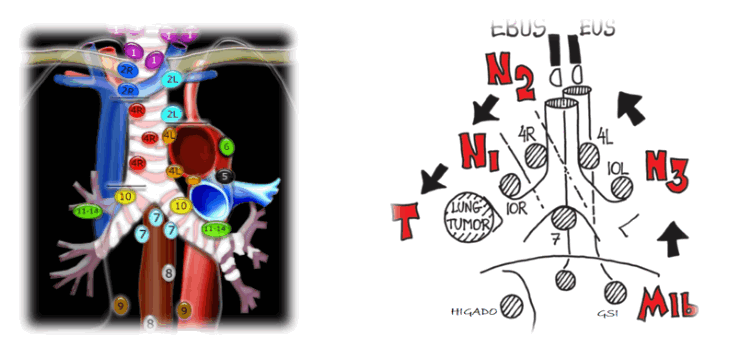
El EBUS brinda acceso a las estructuras cercanas a las vías respiratorias grandes, hasta bronquios lobares, incluyendo los grupos ganglionares mediastinales en las estaciones paratraqueales superiores e inferiores, derechas e izquierdas (2 L, 2R, 4 L y 4R), los ganglios subcarinales (7) así como las estaciones ganglionares hiliares 10, 11 y 12, derechas e izquierdas.
Si se lo complementa con la endosonografía transesofágica (EUS), podemos acceder a las estaciones ganglionares paraesofágicas y del ligamento (8 y 9) así como a la glándula suprarrenal izquierda. La minuciosidad para la estadificación por punción endoscópica del mediastino, ha sido clasificada en 4 niveles10 . Nivel A (muestreo completo) se define como el muestreo de cada ganglio linfático visible en cada estación (1, 2R, 2L, 3, 4R, 4L y 7) utilizando al menos tres pases por ganglio. Nivel B (evaluación sistemática) biopsiar las estaciones 2R, 2L, 4R, 4L y 7. La estadificación de nivel C (evaluación selectiva) se define por la aspiración de al menos un ganglio linfático anormal (=1 cm por TC o ecografía). D, o sea observación sin toma de muestra se considera insuficiente. El número de pases a realizar al aspirar una estación de ganglios linfáticos es un área de considerable interés. La evidencia sugiere que el rendimiento diagnóstico para la detección de células malignas no aumenta por encima de los tres pases. Si se usa el examen rápido en el sitio del procedimiento (ROSE), se deberán realizar aspiraciones repetidas hasta que se obtenga el material celular adecuado (p. ej., suficiente para un diagnóstico específico o al menos 30% de linfocitos) o se completen cinco pases. Todo el examen puede realizarse con la misma aguja, y en este caso, el muestreo debe comenzar por las estaciones N3, o sea hiliares y mediastinales contralaterales al tumor, siguiendo por las estaciones N2 y por ultimo N1, evitando de este modo la contaminación de estaciones que empeorarían el estadío.
La apariencia ecográfica de los ganglios sugiera la probabilidad de infiltración metastásica de los mismos. En un estudio que incluyó 459 ganglios metastásicos en 298 pacientes con cáncer de pulmón y 176 ganglios linfáticos reactivos en 90 pacientes con procesos inflamatorios no específicos, se avaluó la apariencia de los ganglios y se la comparó con los resultados anatomopatológicos finales y el seguimiento clínico. La conclusión fue que la combinación de dos o más características asignadas a malignidad podían predecir el resultado de la biopsia, con una sensibilidad superior al 80% pero con una especificidad del 55%, lo que ayuda a seleccionar los ganglios a punzar, pero no evita la toma de muestra11. Los criterios ecográficos de malignidad incluyen forma redondeada, tamaño mayor de 1cm. en el eje corto, ecogenicidad heterogénea, densidad hiperecogénica central, ausencia de estructura hiliar central y margen bien delimitado. La sensibilidad de la punción transbronquial controlada por ecografía ha sido evaluada en numerosos trabajos. En una revisión sistemática que analizó datos de 2756 pacientes sometidos a EBUS-TBNA, la mediana de sensibilidad fue del 89 % (rango, 46–97 %) y la mediana del VPN fue del 91 %12. El consenso de tres metaanálisis previos fue que la probabilidad de tener enfermedad metastásica mediastínica después de recibir una endosonografía negativa era del 13-15%, lo que no es lo suficientemente bajo como para evitar la necesidad de confirmación quirúrgica.
Reestadificación
En un estudio de Herth F y Col13. Para investigar la sensibilidad y precisión de la aspiración con aguja transbronquial guiada por ecografía endobronquial (EBUS-TBNA) para la reestadificación del mediastino después de la quimioterapia de inducción en pacientes con cáncer de pulmón de células no pequeñas (NSCLC), se revisaron ciento veinticuatro pacientes consecutivos con enfermedad en estadio IIIA-N2 comprobada en tejido que fueron tratados con quimioterapia de inducción y que se habían sometido a una nueva estadificación mediastínica mediante EBUS-TBNA. Se detectaron metástasis ganglionares persistentes mediante EBUS-TBNA en 89 pacientes (72%). La sensibilidad general, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión diagnóstica de EBUS-TBNA para la reestadificación mediastínica después de la quimioterapia de inducción fueron del 76 %, 100 %, 100 %, 20 % y 77 %, respectivamente, Concluyendo que el EBUS-TBNA es una prueba sensible, específica, precisa y mínimamente invasiva para la reestadificación mediastínica de pacientes con NSCLC. Sin embargo, debido al bajo valor predictivo negativo, los hallazgos negativos para el tumor deben confirmarse mediante la estadificación quirúrgica antes de la toracotomía.
Análisis moleculares
Las muestras obtenidas con la EBUS-TBNA constituyen un material adecuado para estudiar un perfil inmunológico. En un estudio de Johns Hopkins University14 , de 85 muestras citológicas positivas para cáncer de pulmón no microcítico, 81 (95%) presentaban material adecuado para estudios moleculares avanzados. Por lo que concluyeron que el método es útil también para diagnóstico.
Seguridad
Una revisión sistemática realizada en 200915 que incluyo 20 publicaciones señaló que en ninguno de los estudios incluidos se reportaron complicaciones significativas. Otra publicación16 que incluyó 3123 procedimientos en un período de 5 años, reporto 5 complicaciones (0,16%) que requirieron hospitalización. Todas se resolvieron sin mortalidad. Para evaluar la seguridad de EBUS-TBNA para la estadificación y el diagnóstico del cáncer de pulmón en Japón, la Sociedad Japonesa de Endoscopia Respiratoria (JSRE) realizó una encuesta nacional sobre las complicaciones asociadas con su uso. As respuestas recogidas reflejaron 90 complicaciones en 7354 procedimientos (1,23%) siendo la hemorragia la complicación mas frecuente, seguida por las infecciones. 4 complicaciones constituyeron riesgo vital y se informo de una muerte por infarto cerebral severo17. Por lo que puede concluirse que la aspiración transbronquial con aguja guiada por ecografía endobronquial es un procedimiento seguro y muy preciso para el examen y la estadificación de los ganglios linfáticos mediastínicos e hiliares en pacientes con malignidad pulmonar conocida o sospechada.
Conclusiones
La estadificación mediastinal del cáncer de pulmón no microcítico es crucial para determinar el tratamiento a seguir, así como para establecer un pronóstico de la enfermedad, siendo también fundamental para el intercambio de la información científica. La iniciamos con procedimientos no invasivos usando principalmente la tomografía computada, la tomografía por emisión de positrones o ambas combinadas (PET-TC). Cuando es necesario, se continua con métodos invasivos para el muestreo de los ganglios siendo el EBUS el recurso inicial recomendado por las guías actuales. Este constituye un método minimamente invasivo, de gran precisión y con muy escasas complicaciones. En determinadas circunstancias, un EBUS negativo debe confirmarse por métodos quirúrgicos.