Patrones tomográficos en el infarto pulmonar tromboembólico
Masdeu Martín1, Blanco Karina2, Torres Ruben1, Codinardo Carlos1
1 Sección Neumonología, Hospital Ignacio Pirovano, Ciudad Autónoma de Buenos Aires, Argentina
2 Sección Neumonología, Hospital Rivadavia, Ciudad Autónoma de Buenos Aires, Argentina
Introducción y epidemiología
El tromboembolismo pulmonar (TEP) constituye un desafío diagnóstico que requiere estrategias diagnósticas adecuadas. La información clínica, los datos de laboratorio como el dímero-D, la angiotomografía torácica, la ecografía Doppler, la gammagrafía de ventilación perfusión y la eco cardiografía, ayudan a establecer la probabilidad diagnóstica y la gravedad del paciente.
En el abordaje inicial del paciente sintomático respiratorio, los servicios de urgencias suelen disponer de la tomografía de tórax. Cuando se realiza sin protocolo para TEP, determinados hallazgos en correlación con la clínica conducen a una alta sospecha diagnóstica, sobre todo cuando hay compromiso parenquimatoso, como ocurre en el caso del infarto pulmonar (IP) tromboembólico. Tal es así, que una consolidación periférica subpleural con las características que describiremos más adelante puede ser la primera manifestación de un TEP.
El IP se manifiesta radiológicamente en aproximadamente un tercio de los pacientes que desarrollan un TEP agudo, con una prevalencia estimada del 31%.1 Hampton y Castleman fueron los primeros en describir en detalle las características radiológicas del IP, publicando una serie de 370 pacientes con embolia pulmonar confirmada por autopsia, en donde el IP fue confirmado en el 70% de los casos.2
La insuficiencia cardíaca crónica históricamente se ha relacionado con el IP debido a la hipertensión pulmonar venosa sostenida que altera el sistema de circulación colateral.3,4 El tabaquismo cumple su rol perpetuando la inflamación sistémica y el aumento de la permeabilidad en la barrera alveolocapilar, mientras que la anticoncepción oral y la enfermedad oncológica son reconocidos factores protrombóticos. La talla corporal elevada fue descripta recientemente como un factor de riesgo en pacientes jóvenes.1
Fisiopatología
Una característica única del pulmón es que recibe suministro de oxígeno de un total de tres fuentes: sangre desoxigenada de las arterias pulmonares, sangre oxigenada de la circulación bronquial y difusión directa de oxígeno desde los alvéolos. Esto le da al pulmón cierta resiliencia en el caso de una embolia pulmonar, motivo por el cual el IP no es tan frecuente. El sistema vascular pulmonar conduce el flujo sanguíneo desde el ventrículo derecho a través de las arterias pulmonares al sistema capilar alveolar. Desde allí la sangre oxigenada fluye a través de las venas pulmonares hasta la aurícula izquierda y la circulación sistémica. El sistema vascular bronquial se encuentra conformado por las arterias bronquiales, responsables de la mayor parte del aporte de oxígeno al parénquima pulmonar.
Forman una amplia red de anastomosis precapilares y poscapilares con el sistema pulmonar. Estas características sumadas a que las arterias bronquiales pueden
incrementar significativamente su flujo, constituyen un reaseguro a la hora de compensar el aporte de oxígeno ante una eventual isquemia pulmonar. De esta forma, una lesión vascular pulmonar oclusiva no suele conducir a un IP, gracias a la existencia de la perfusión colateral por reclutamiento de las arterias
bronquiales. Por otro lado, la mayor presión de las arterias bronquiales, en combinación con un aumento local de la permeabilidad vascular y daño endotelial, puede resultar localmente en una hemorragia pulmonar capilar transitoria, reabsorbiéndose con regeneración tisular posterior. 1,4,5
El TEP, sin embargo, puede evolucionar a IP en determinadas circunstancias como puede suceder ante un flujo reducido en las arterias bronquiales (hipotensión) o una presión incrementada en las venas pulmonares (edema intersticial), situaciones en las cuales la perfusión visceral pulmonar se compromete. El parénquima necrótico será reemplazado por tejido fibroso, observándose habitualmente una cicatríz residual por depósito de colágeno con retracción de la pleura adyacente. El riesgo de IP será mayor en aquellos casos donde se ocluyen los vasos distales menores a 3 mm, a diferencia del TEP con compromiso de arterias pulmonares centrales. Esto se debe a que es más probable que la circulación pulmonar colateral sea suficiente en la obstrucción central. 6,7,8
Presentación clínica
El dolor torácico pleurítico con o sin disnea súbita es la presentación clínica más frecuente en el IP tromboembólico. La hemoptisis es menos habitual, presentándose en menos del 20% de los pacientes con IP diagnosticado radiológicamente. También puede presentarse con tos, dolor precordial, mareo y síncope. Los signos más frecuentes incluyen taquipnea, edema de miembro inferior, dolor en cara posterior de la pierna (signo de Homans), taquicardia, rales crepitantes pulmonares, disminución del murmullo vesicular, acentuación del componente pulmonar del segundo ruido cardíaco y fiebre simulando una neumonía aguda de la comunidad (NAC).9
Presentación tomográfica
El IP suele presentarse en forma unilateral (77% a 87% de los casos), con mayor predilección por el lóbulo inferior derecho. Múltiples estudios demuestran marcada predilección por los lóbulos inferiores. Se ha planteado la hipótesis de que esto se debería a la influencia de la fuerza de gravedad sobre la interrelación entre la presión alveolar, la presión arterial pulmonar y la presión arterial bronquial.7,8
A nivel tomográfico el IP puede presentarse frecuentemente como una consolidación pulmonar periférica en forma de cuña, con su base en contacto con la pleura visceral (lateral,diafragmática, mediastinal o interlobar).9,10(Fig 1)
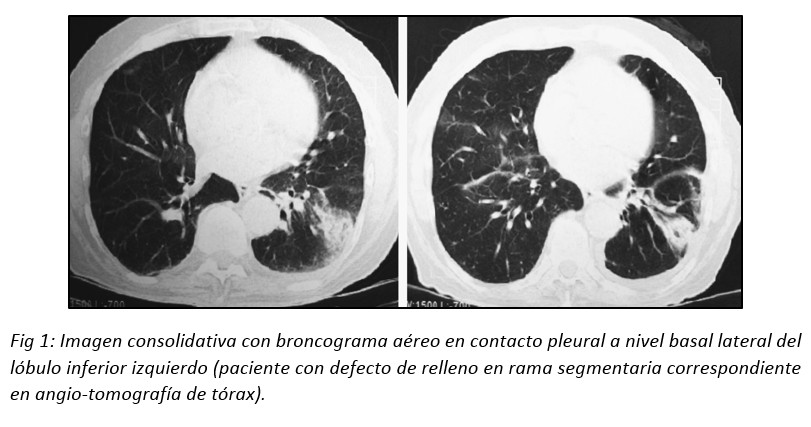
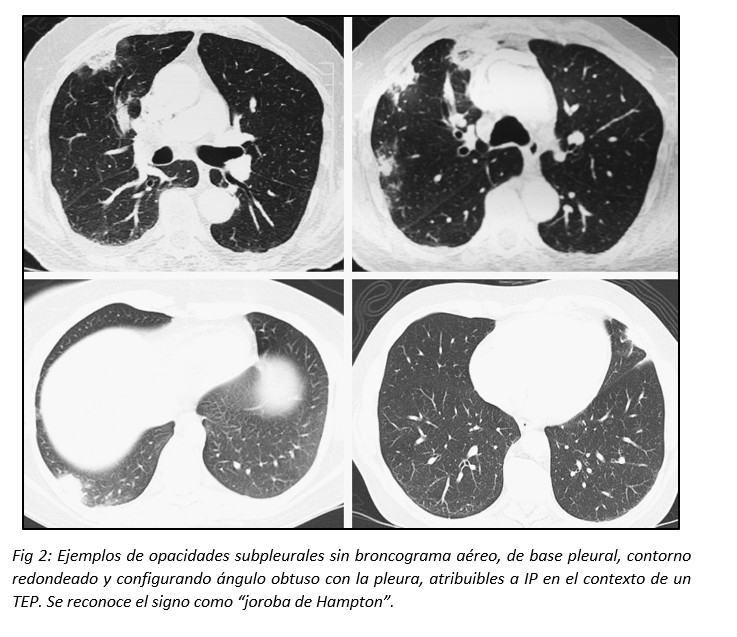
La opacidad puede presentarse sin broncograma aéreo y adoptar una forma redondeada (signo tomográfico conocido como “joroba de Hampton”).1,2 Es habitual que los infartos pulmonares sean confundidos con una NAC, enfermedad granulomatosa o neoplásica debido a la creencia de que el IP debe tener indefectiblemente morfología triangular con su ápex señalando el hilio pulmonar. Hampton y Castleman, y posteriormente Fleischner, describieron que este concepto es erróneo, debido a que el sector apical del área pulmonar afectada por la isquemia tromboembólica suele verse respetada por el infarto, al resultar suficiente el flujo sanguíneo colateral.11,12,13 (Fig 2)
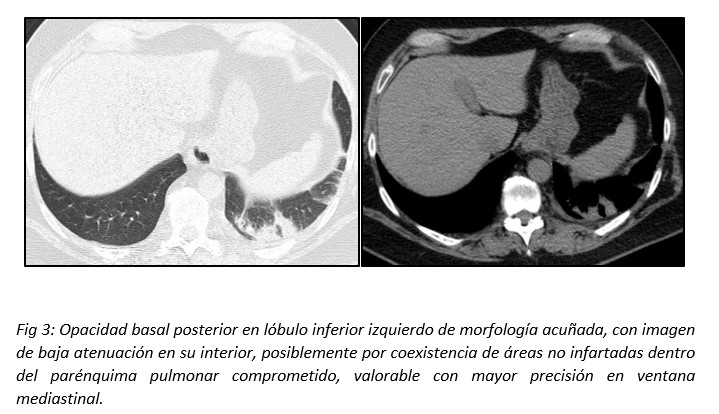
Las opacidades pueden presentar imágenes de baja atenuación en su interior, atribuibles a áreas no infartadas con parénquima pulmonar sano. Esta característica puede observarse con mayor precisión en la ventana mediastinal. Los sectores de baja atenuación dispersos dentro de la lesión también pueden ser un signo de necrosis o fruto de la distribución geográfica irregular de una hemorragia pulmonar focal en el sitio de isquemia.14(Fig 3)
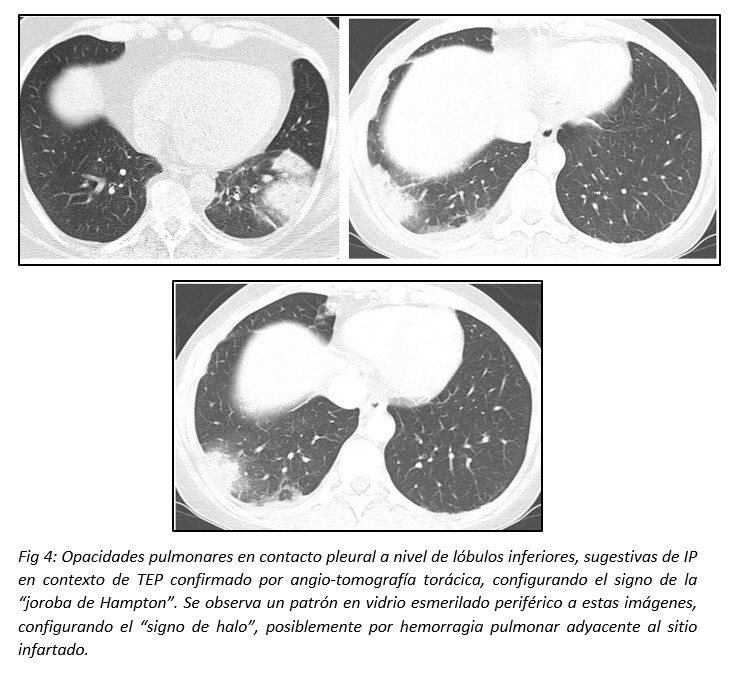
Alrededor del área infartada puede observarse el “signo del halo” (vidrio esmerilado periférico) como expresión de hemorragia adyacente a la zona isquémica. Puede observarse también disminución del realce pulmonar normal en el lóbulo pulmonar afectado.12,13,15 (Fig 4)
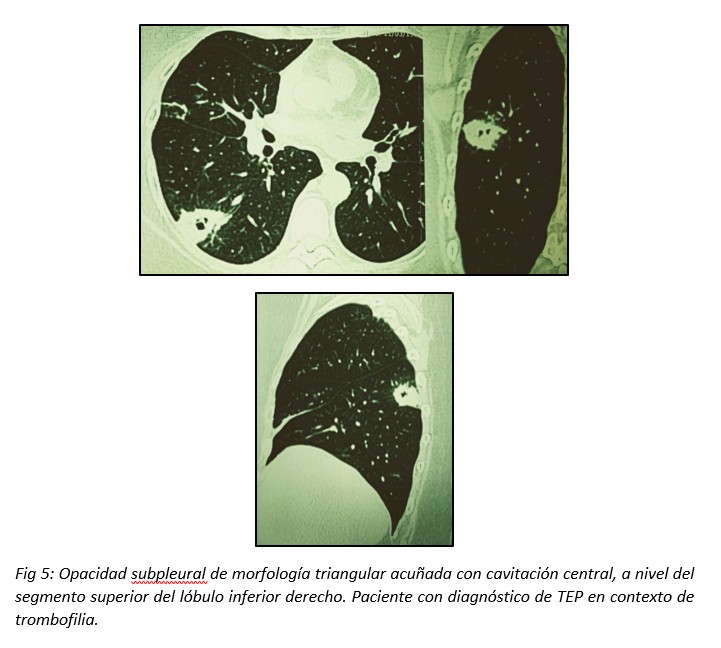
La cavitación es rara, y suele asociarse al embolismo séptico. En el contexto de un TEP la frecuencia de cavitación es del 4-5%.14,15 Puede representar una cavitación pulmonar aséptica o una sobreinfección de la región afectada. Los IP cavitados podrían predominar en lóbulos superiores, siendo habitualmente únicos con área de consolidación adyacente.16 (Fig 5)
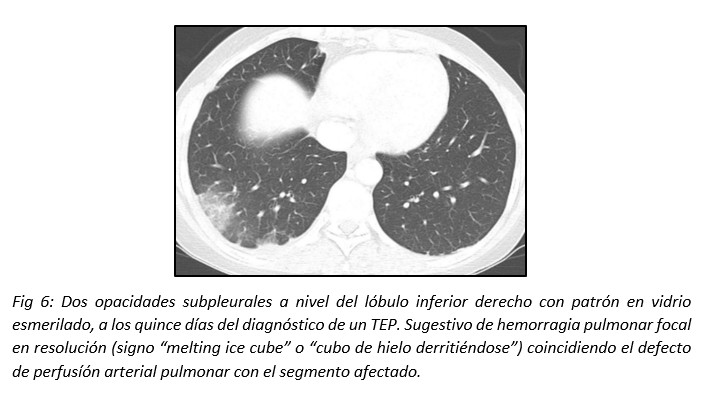
En los casos donde se produce hemorragia pulmonar sin infarto, las opacidades resuelven en alrededor de una semana, manteniendo transitoriamente su forma con densidad en vidrio esmerilado (“melting ice cube sign” o “cubo de hielo derritiéndose”).17 (Fig 6)
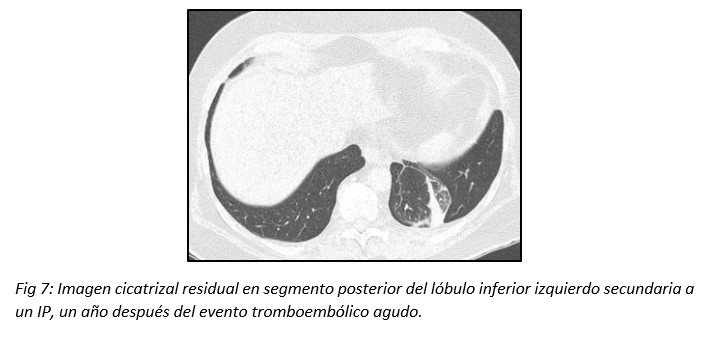
Cuando se desarrolla un IP puede demorar meses en remitir la imagen, curando finalmente con una cicatríz lineal residual.13,14 (Fig 7)
Además de los signos tomográficos de IP descriptos previamente, los siguientes hallazgos deben hacernos sospechar la existencia de una embolia pulmonar: pérdida de volumen pulmonar (elevación del hemidiafragma, descenso de cisura mayor), oligohemia global (acompañada de hipertensión pulmonar), signo de Westermark (hiperclaridad local por oligohemia al producirse obliteración de una rama de la arteria pulmonar), signo de Fleischner (dilatación pretrombótica
de un segmento de la arteria pulmonar en el sitio donde se enclava el émbolo), atelectasias laminares (por alteraciones locales del surfactante) y derrame
pleural inflamatorio homolateral al sitio infartado.1,8
Diagnósticos diferenciales:
Los diagnósticos diferenciales del IP tromboembólico incluyen la NAC (sobre todo ante un patrón tomográfico consolidativo, que en la NAC suele ser de localización más central a cierta distancia de la pleura), la hemorragia pulmonar focal (cambios isquémicos por TEP sin infarto), la embolia pulmonar séptica (eventual cavitación), la aspergilosis pulmonar angioinvasiva (joroba de Hampton con signo del halo asociado) y el cáncer pulmonar17 (los nódulos y masas de origen neoplásico suelen ubicarse más centralmente, alejados de la pleura visceral). En relación a este último caso, cuando en el diagnóstico diferencial con cáncer pulmonar se solicita un PET-TC, a diferencia de las lesiones neoplásicas, el IP presenta una captación típica del radiotrazador en la cual se distribuye a lo largo de la periferia de la lesión, sin captación dentro de la consolidación propiamente dicha (“rim sign” o “signo del borde”).18,19
Conclusiones:
Es relevante conocer la morfología del IP en la tomografía de tórax para considerarlo dentro los posibles diagnósticos diferenciales, sobre todo la NAC. Los síntomas de presentación suelen ser inespecíficos y pueden generar confusión ante una imagen consolidativa en la tomografía de tórax. Una opacidad pulmonar subpleural en forma de cuña, con o sin broncograma aéreo, localizada en lóbulos inferiores, obliga a considerar la patología isquémica pulmonar cuando los antecedentes, síntomas y signos configuran un contexto clínico adecuado para enfermedad tromboembólica. De esta manera, un hallazgo de este tipo en la tomografía de tórax puede ser la primera manifestación de un TEP, y la alta sospecha diagnóstica nos permitirá continuar con el algoritmo diagnóstico adecuado.
Bibliografía:
1- Miniati M, Bottai M, Ciccotosto C, et al. Predictors of Pulmonary Infarction. Medicine. 2015;94(41):e1488.
2- Hampton AO, Castleman B. Correlation of postmortem chest teleroentgenograms with autopsy findings with special reference to pulmonary embolism and infarction. Am J Roentgenol Radium Ther. 1940;43:305–326.
3- Parker BM, Smith JR. Pulmonary embolism and infarction: a review of the physiologic consequences of pulmonary arterial obstruction. Am J Med. 1958;24:402–427.
4- Tsao MS, Schraufnagel D, Wang NS. Pathogenesis of pulmonary infarction. Am. J. Med. 1982;72 (4): 599-606.
5- Kroegel C, Reissig A. Principle mechanisms underlying venous thromboembolism: epidemiology, risk factors, pathophysiology and pathogenesis. Respiration. 2003 Jan-Feb;70(1):7-30.
6- Schraufnagel DE, Tsao MS, Yao YT, et al. Factors associated with pulmonary infarction. A discriminant analysis study. Am J Clin Pathol. 1985;84:15–18.
7- Choi SH, Cha SI, Shin KM, Lim JK, Yoo SS, Lee SY, Lee J, Kim CH, Park JY, Lee DH. Clinical Relevance of Pleural Effusion in Patients with Pulmonary Embolism. Respiration. 2017;93(4):271-278.
8- Islam M, Filopei J, Frank M, Ramesh N, Verzosa S, Ehrlich M, Bondarsky E, Miller A, Steiger D. Pulmonary infarction secondary to pulmonary embolism: An evolving paradigm. Respirology. 2018
9- Chengsupanimit T, Sundaram B, Lau WB, Keith SW, Kane GC. Clinical characteristics of patients with pulmonary infarction - A retrospective review. Respir Med. 2018 Jun;139:13-18.
10- Miniati M. A 48-year-old man with a pleural-based consolidation. CMAJ. 2013 Sep 3;185(12):1059-62.
11- Yousem SA. The surgical pathology of pulmonary infarcts: diagnostic confusion with granulomatous disease, vasculitis, and neoplasia. Mod Pathol. 2009;22:679–685.
12- Frazier AA, Galvin JR, Franks TJ, Rosado-De-Christenson ML. From the archives of the AFIP: pulmonary vasculature: hypertension and infarction. Radiographics. 2000 Mar-Apr;20(2):491-524
13- He H, Stein MW, Zalta B, Haramati LB. Pulmonary infarction: spectrum of findings on multidetector helical CT. J Thorac Imaging. 2006 Mar;21(1):1-7.
14- Revel MP, Triki R, Chatellier G, Couchon S, Haddad N, Hernigou A, Danel C, Frija G. Is It possible to recognize pulmonary infarction on multisection CT images? Radiology. 2007 Sep;244(3):875
15- Fleischner FG. Roentgenology of the pulmonary infarct. Semin Roentgenol. 1967;2:61-76
16- Blanco s, Gómez A, Hernando F, Bustos A, Cascón A, Torres AJ, Balibrea JL. Nódulo pulmonar cavitado con hemoptisis: infarto pulmonar bilateral cavitado. Cir Esp. 65 (6): 526-527.
17- Woesner ME, Sanders I, White GW. The melting sign in resolving transient pulmonary infarction. Am J Roentgenol Radium Ther Nucl Med. 1971;111:782–790.
18- George CJ, Tazelaar HD, Swensen SJ, et al. Clinicoradiological features of pulmonary infarcts mimicking lung cancer. Mayo Clin Proc. 2004;79:895–898.
19- Soussan M, Rust E, Pop G, et al. The rim sign: FDG-PET/CT pattern of pulmonary infarction. Insights into imaging. 2012; 3 (6):629-33.


